 par Antonio Pajuelo
par Antonio Pajuelo Les abeilles jouent un rôle crucial dans la pollinisation, un processus vital pour la santé des écosystèmes. Cependant, au cours des dernières décennies, les populations d’abeilles mellifères ont diminué de manière significative en raison de multiples facteurs, y compris le stress nutritionnel, l’incidence de divers pathogènes et parasites, et l’exposition aux pesticides (Castelli et al. 2020).
Le stress nutritionnel est provoqué notamment par l’augmentation de la superficie des monocultures, qui a réduit la disponibilité en pollen varié nécessaire pour répondre aux besoins des abeilles.
À l’échelle individuelle, la consommation de pollen de qualité est l’un des facteurs qui influence la longévité des abeilles. À l’échelle de la colonie, son ingestion par les jeunes abeilles augmente la taille des glandes hypopharyngiennes (DeGrandi-Hoffman et al. 2010). Leur fonction est essentielle dans la sécrétion de la fraction protéique de la gelée royale et de la gelée d’ouvrière, et par conséquent dans le régime alimentaire des larves, de la reine et des ouvrières qui composent la colonie (Figure 1).
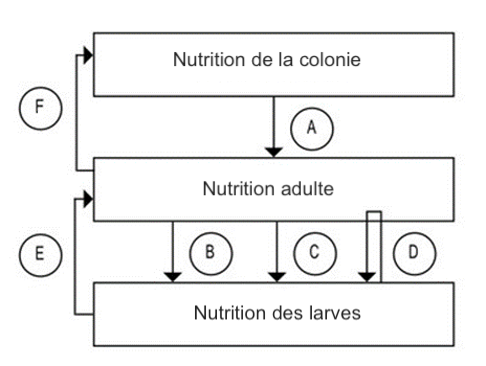
A : Dépendance des adultes aux aliments stockés dans la colonie ; B : Relation avec la qualité des larves ; C : Régulation du nombre de larves ; D : Cannibalisme ; E : Impact de la nutrition larvale sur la génération adulte suivante ; F : Impact des adultes sur la nutrition de la colonie. Modifié de Brodschneider et al., 2010.
C’est pourquoi l’évolution des glandes hypopharyngiennes est corrélée avec l’âge des abeilles et leur rôle au sein de la colonie (Corby-Harris et al., 2018). Cependant, la carence en pollen peut non seulement avoir un impact négatif sur la population d’abeilles en raison du manque de nourriture pour nourrir les larves, mais aussi sur la santé en général (Figure 2), en affectant également le métabolisme des abeilles, leur immunité, leur tolérance aux pathogènes et leur sensibilité aux pesticides (Di Pasquale et al., 2013).
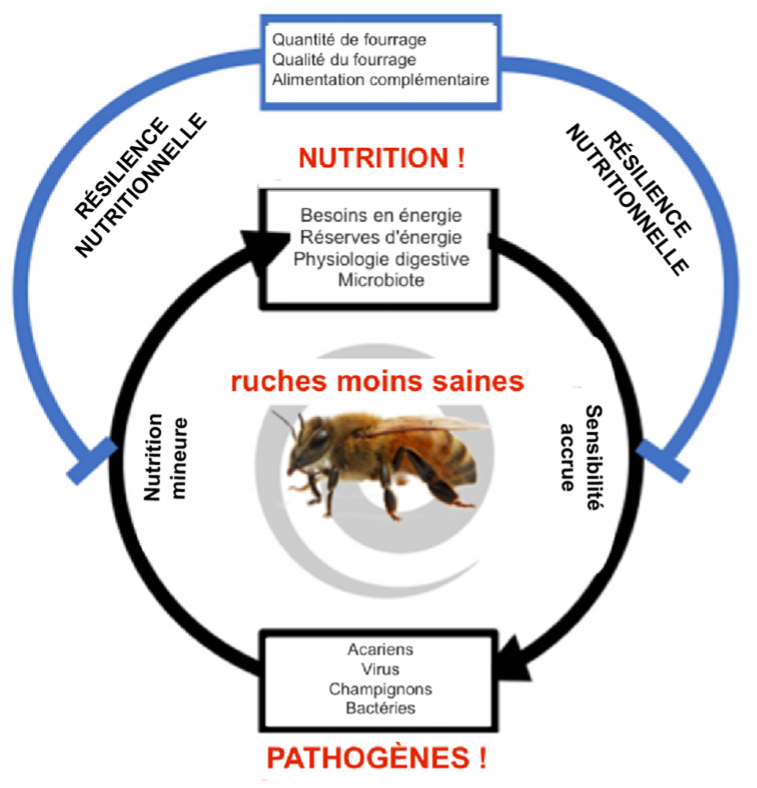
La relation entre immunité et nutrition a été largement étudiée chez de nombreux organismes, y compris les abeilles. Le pollen fournit les acides aminés essentiels nécessaires à la synthèse des peptides antimicrobiens, active les voies métaboliques et l’expression des gènes liés à la longévité, à la réponse immunitaire et à la détoxification des pesticides. Le nectar et le miel apportent l’énergie nécessaire pour activer la réponse humorale et cellulaire, en plus de contenir des métabolites secondaires aux propriétés antimicrobiennes (DeGrandi-Hoffman et al. 2015).
En comparaison avec d’autres insectes, comme par exemple les moustiques, les abeilles ont un système immunitaire plus simple, complété par l’immunité sociale. À l’échelle individuelle, les abeilles disposent de plusieurs barrières qui leur permettent de se défendre contre les parasites et les pathogènes. L’exosquelette ou la membrane péritrophique de l’intestin seraient les premières lignes de défense. Si un parasite ou un pathogène franchit ces barrières, la seconde ligne serait la réponse immunitaire cellulaire et humorale.
La réponse humorale est principalement associée à certains peptides antimicrobiens, tels que l’abaecine, la défensine ou l’hyménoptaecine. La réponse cellulaire est médiée par les hémocytes (cellules présentes dans l’hémolymphe) et leur réponse, comme la phagocytose ou l’encapsulation (Negri et al., 2019).
Un exemple de cette réponse immunitaire est l’action des enzymes antioxydantes comme la phénoloxydase. Celle-ci est responsable de la formation de mélanine utilisée par le système immunitaire pour se défendre. En effet, la mélanisation est considérée comme l’une des réponses de défense les plus importantes chez les abeilles adultes (Negri et al. 2019). Une nutrition adéquate est cruciale, car la synthèse de ces enzymes implique une dépense énergétique significative et nécessite des acides aminés essentiels acquis uniquement par l’alimentation.
Cette relation entre nutrition et immunité est compromise par la présence de certains parasites, comme le varroa. L’acarien, en se nourrissant des corps gras et de l’hémolymphe (Han et al., 2024), entraîne une dénutrition, avec des niveaux plus bas de protéines chez les abeilles adultes et les nymphes parasitées (Aronstein et al., 2012). Dans ces conditions, il y a une diminution du métabolisme des protéines, en plus de l’inhibition des gènes liés à l’immunité, augmentant ainsi le taux de réplication des virus (DeGrandi-Hoffman et al., 2015).
Par ailleurs, le stress nutritionnel affecte également le microbiote et, par conséquent, l’immunité, car celle-ci module l’expression des gènes liés au système immunitaire des abeilles. De plus, le microbiote est impliquée dans le métabolisme des abeilles, leur croissance, leur développement et leur défense contre les pathogènes. Lorsqu’il y a un déséquilibre du microbiote (dysbiose), la capacité des abeilles à répondre à divers facteurs de stress est affectée (Raymann et al., 2018).
De nombreuses études ont évalué l’effet du stress nutritionnel sur la santé des abeilles. Par exemple, une étude menée par Castelli et al. (2020) a montré que, dans des conditions de laboratoire, les abeilles nourries avec du pollen d’Eucalyptus grandis présentaient un déséquilibre du microbiote, affectant le système immunitaire et le développement des pathogènes.
Ce pollen a été sélectionné en raison de sa faible teneur en lipides, en acides gras essentiels oméga-3, de son déficit en isoleucine (acide aminé essentiel), et parce que le pourcentage de protéines diminue tout au long de la floraison.
De plus, une réduction de l’expression de la vitellogénine et des gènes liés à l’immunité a été observée, parallèlement à une augmentation de la multiplication de Nosema ceranae. La vitellogénine est une protéine de réserve ayant de multiples fonctions chez les abeilles (nutrition de l’embryon, lien avec la longévité, implication dans la synthèse de la gelée royale, etc.). Elle est utilisée en recherche pour évaluer l’état nutritionnel des abeilles, car ses niveaux sont liés à la qualité de l’alimentation (Ricigliano et al., 2022).
Dans une autre étude récente menée par Corona et al. (2023), l’effet de l’alimentation au pollen sur la santé des abeilles a été évalué. Pour cela, deux groupes ont été constitués en conditions de laboratoire (comprenant des abeilles de différents âges) : nourries avec et sans pollen. Le groupe d’abeilles nourries au pollen a montré une expression accrue des gènes du système immunitaire. Les niveaux de différents virus tels que DWV (virus des ailes déformées), SBV (virus du couvain en sac) ou BQCV (virus des cellules royales noires) ont également été évalués. Les résultats ont montré que le stress nutritionnel et le vieillissement contribuent à augmenter les niveaux de virus. Étonnamment, une augmentation du virus DWV a été observée dans le groupe d’abeilles nourries au pollen. Ces résultats concordent avec d’autres études (Alaux et al., 2011 ; Branchiccela et al., 2019) qui suggèrent qu’une plus grande activité de la machinerie cellulaire pourrait favoriser la multiplication du virus, mais tout en aidant à mieux résister à l’infection.
Parfois, lorsque des carences ou des déficits en pollen existent, les apiculteurs utilisent des suppléments protéiques pour compenser. Bien que ceux-ci ne soient pas équivalents au pollen sur le plan nutritionnel, diverses études montrent un effet positif sur la vigueur des colonies (Noordyke et al., 2022 ; Ricigliano et al., 2022). Cependant, il existe également des études où aucun bénéfice n’est observé après leur application (DeGrandi-Hoffman et al., 2008 ; Mortensen et al., 2019) ou même des effets négatifs (DeGrandi-Hoffman et al., 2016). Les résultats dépendent de nombreux facteurs tels que le moment d’application, les conditions climatiques, la région et l’emplacement du rucher, la qualité de l’aliment ou la disponibilité de ressources externes (nectar et pollen).
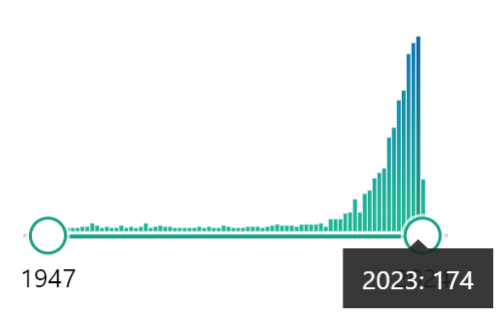
Au cours des dernières décennies, de nombreuses recherches ont été publiées sur la nutrition des abeilles (Figure 3), et la compréhension des besoins nutritionnels des abeilles et de leur impact sur leur santé s’est améliorée. Actuellement, l’objectif est d’utiliser des compléments alimentaires de qualité pour couvrir les carences ponctuelles et améliorer la santé des abeilles, tout en réduisant l’utilisation de produits chimiques pour la gestion des maladies.
Traditionnellement, la qualité du pollen a été liée à sa teneur en protéines et en acides aminés, et les formulations de suppléments protéiques se sont concentrées sur ces éléments. En ce qui concerne les acides aminés essentiels, le travail réalisé par de Groot en 1953 a servi de base jusqu’à aujourd’hui pour établir les besoins minimaux dans les régimes alimentaires. Cependant, de nouvelles propositions émergent en tenant compte des connaissances actuelles.
Dans le travail réalisé par Ricigliano et al. (2022), il est proposé d’établir la relation des acides aminés essentiels en fonction de la leucine, car ce serait l’acide aminé limitant pour la croissance des abeilles. Une autre étude, menée par Castaño et al. (2022), suggère d’ajouter aux suppléments protéiques de l’alanine, de l’asparagine, de la glycine et du glutamate, car bien qu’ils ne soient pas essentiels pour les abeilles adultes, ils le sont pour les larves.
En plus des protéines et des glucides, des travaux récents mettent en évidence que les graisses semblent être un aspect important de la nutrition apicole en raison de leur effet positif sur la santé des abeilles.
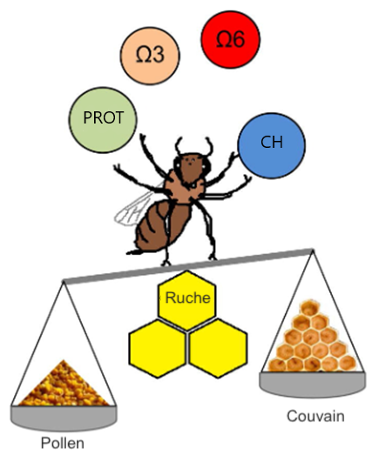
Parmi elles, on trouve les acides gras essentiels, qui doivent être acquis par le régime alimentaire, comme l’acide linoléique (oméga-6) et l’acide linolénique (oméga-3) (Figure 4). Ces acides gras représentent en moyenne 43 % du total des acides gras du pollen, et leur proportion oméga-6 : oméga-3 est d’environ 0,8 (Corby-Harris et al., 2021). Ces deux acides gras sont importants pour les abeilles, car leur carence entraîne un moindre développement des glandes hypopharyngiennes et une capacité d’apprentissage réduite (Arien et al., 2015 ; 2018). En raison de leur importance, il est recommandé de prendre en compte ces nutriments lors de la formulation de suppléments commerciaux (Figure 4) (Avni et al., 2014 ; Corby-Harris et al., 2021).
Récemment, des produits nutraceutiques tels que des prébiotiques (composés favorisant la croissance du microbiote), des probiotiques (organismes vivants bénéfiques) ou des postbiotiques (composés bioactifs produits par les probiotiques) ont fait leur apparition sur le marché international avec l’objectif mentionné précédemment. Il existe également des produits à base d’extraits végétaux utilisés dans les pâtées protéinées ou les sirops, qui aident à prévenir les déséquilibres intestinaux liés à Nosema spp. (Gajger et al., 2011).
Un exemple d’utilisation de prébiotiques serait l’emploi de spiruline comme substitut de pollen. Sur le plan nutritionnel, cette microalgue est riche en acides aminés essentiels et en lipides. Selon l’étude menée par Ricigliano et al. (2020), son application a amélioré l’état nutritionnel des abeilles, augmentant l’expression de la vitellogénine, la taille corporelle et l’abondance du microbiote du tractus digestif.
L’utilisation des probiotiques nécessite encore plus de recherches. Des études récentes (Damico et al., 2023 ; Anderson et al., 2024) suggèrent que les probiotiques formulés avec des espèces natives du microbiote des abeilles pourraient être efficaces, tandis que ceux formulés avec des bactéries qui ne sont pas propres au tractus digestif ne semblent pas être efficaces.
En résumé, bien qu’il reste encore beaucoup à étudier, une bonne nutrition est fondamentale pour la santé des abeilles, car elle leur fournit les nutriments nécessaires à leur développement, à leur fonction immunitaire et à leur capacité de résistance aux maladies et aux parasites.
 par Jose Antonio Babiano
par Jose Antonio Babiano  par Véto-pharma
par Véto-pharma Alaux, C., Dantec, C., Parrinello, H. & Le Conte, Y. 2011. Nutrigenomics in honey bees: Digital gene expression analysis of pollen’s nutritive effects on healthy and varroa-parasitized bees. BMC Genomics. 12, 496 (2011)
Anderson, K. E., Allen, N. O., Copeland, D. C., Kortenkamp, O. L., Erickson, R., Mott, B. M., Oliver, R. 2024. A longitudinal field study of commercial honey bees shows that non‑native probiotics do not rescue antibiotic treatment, and are generally not beneficial. Scientific Reports, 14:1954. https://doi.org/10.1038/s41598-024-52118-z
Arien, Y., Dag, A., Zarchin, S., Masci, T., Shafir, S. (2015). Omega-3 deficiency impairs honey bee learning. PNAS 112 (51) 15761-15766. https://doi.org/10.1073/pnas.151737511.
Arien, Y., Dag, A., Shafir, S. (2018). Omega-6:3 ratio more than absolute lipid level in diet affects associative learning in honey bees. Frontiers in Psychology 19. https://doi.org/10.3389/fpsyg.2018.01001
Aronstein, K. A., Vega, S. E., Westmiller, R., Douglas, S. A. E. 2012. How Varroa parasitism affects the immunological and nutritional staus of the honey bee, Apis mellifera. Insects, 3:601-615.
Avni, D., Hendriksma, H. P., Dag, A., Uni, Z., Shafir, S. 2014. Nutritional aspects of honey bee-collected pollen and constraints on colony development in the eastern Mediterranean. Journal of Insect Physiology, 69:65-73. DOI: 10.1016/j.jinsphys.2014.07.001
Branchiccela, B., Castelli, L., Corona, M., Díaz-Cetti, S., Invernizzi, C., Martínez de la Escalera, G., Mendoza, Y., Santos, E., Zunino, P., Antúnez, K. 2019. Impact of nutritional stress on the honeybee colony health. Scientific Reports. 9:10156. https://doi.org/10.1038/s41598-019-46453-9
Brodschneider, R., Crailsheim, K. 2010. Nutrition and health in honey bees. Apidologie, 41:278-294. DOI: 10.1051/apido/2010012
Castaños, C. E. 2022. The dynamic metabolome of honey bee (Apis mellifera) under starvation and suboptimal nutrition. [Doctoral Thesis, University of Western Australia]. Research Repository-University of Western Australia.
Castelli, L., Branchiccela, B., Garrido, M., Invernizzi, C., Porrini, M., Romero, H., Santos, E., Zunino, P., Antúnez, K. Impact of nutritional stress on honeybee gut microbiota, immunity, and Nosema ceranae infection. Microb. Ecol. 2020, 80, 908–919.
Corby-Harris, V., Bennet, M. M., Deeter, M. E., Snyder, L., Meador, C., Welchert, A. C., Hoffman, A., Obernesser, B. T., Carroll, M. J. 2021. Fatty acid homeostasis in honey bees (Apis mellifera) fed commercial diet supplements. Apidologie, 52:1195-1209.
Corby-Harris, V., Snyder, L. A. 2018. Measuring hypopharyngeal gland acinus size in honey bee (Apis mellifera) workers. J. Vis. Exp. 139, e58261, doi:10.3791/58261
Corona, M., Branchiccela, B., Alburaki, M., Palmer-Young, E. C., Madella, S., Chen, Y., Evans J. D. 2023. Decoupling the effects of nutrition, age, and behavioral caste on honey bee physiology, immunity, and colony health. Front. Physiol. 14:1149840. doi: 10.3389/fphys.2023.1149840
Damico, M. E., Beasley, B., Greenstein, D., Raymann, K. 2023. Testing the effectiveness of a commercially sold probiotic on restoring the gut microbiota of honey bees: a field study. Probiotics and Antimicrobial Proteins, DOI: 10.1007/s12602-023-10203-1
DeGrandi-Hofman, G., Chen, Y. 2015. Nutrition, immunity and viral infections in honey bees. Current Opinion in Insect Science, 10:170-176. http://dx.doi.org/10.1016/j.cois.2015.05.007
DeGrandi-Hoffman, G., Chen, Y., Huang, E., Huang, M. H. 2010. The effect of diet on protein concentration, hypopharyngeal gland development and virus load in worker honey bees (Apis mellifera L.). Journal of Insect Physiology. 56(9):1184-1191
DeGrandi-Hoffman, G., Chen, Y., Rivera, R., Carroll, M., Chambers, M., Hidalgo, G., de Jong, E. W. 2016. Honey bee colonies provided with natural forage have lower pathogen loads and higher overwinter survival than those fed protein supplements. Apidologie, 47, 186–196. https://doi.org/10.1007/s13592-015-0386-6
DeGrandi-Hoffman, G., Wardell, G., Ahumada-Segura, F., Rinderer, T., Danka, R., Pettis, J. 2008. Comparisons of pollen substitute diets for honey bees: Consumption rates by colonies and effects on brood and adult populations. Journal of Apicultural Research, 47, 265–270. https://doi.org/10.3896/IBRA.1.47.4.06
Di Pasquale, G., Salignon, M., Le Conte, Y., Belzunces, L. P., Decourtye, A., Kretzschmar, A., Suchail, S., Brunet, J. L., Alaux, C. 2013. Influence of pollen nutrition on honey bee health: do pollen quality and diversity matter? PLoS ONE 8(8): e72016. doi:10.1371/journal.pone.0072016
Dolezal, A. G., Toth, A. L. 2018. Feedbacks between nutrition and disease in honey bee health. Current Opinion in Insect Science, 26:114-119. https://doi.org/10.1016/j.cois.2018.02.006
Gajger, I. T., Kozaric, Z., Berta, D., Nejedli, S., Petrinec, Z. 2011. Effect of the herbal preparation Nozevit on the mid-gut structure of honeybees (Apis mellifera) infected with Nosema sp. spores. Veterinarni Medicina, 56(7):344-351
Han, B., Wu, J., Wei, Q., Liu, F., Cui, L., Rueppell, O., Xu, S. 2024. Life-history stage determines the diet of ectoparasitic mites on their honey bee hosts. Nature Communications, 15:725. https://doi.org/10.1038/s41467-024-44915-x
Mortensen, A. N., Jack, C. J., Bustamante, T. A., Schmehl, D. R., & Ellis, J. D. 2019. Effects of supplemental pollen feeding on honey bee (Hymenoptera: Apidae) colony strength and Nosema spp. infection. Journal of Economic Entomology, https://doi.org/10.1093/jee/toy341
Negri, P., Villalobos, E., Szawarski, N., Damiani, N., Gende, L., Garrido, M., Maggi, M., Quintana, S., Lamattina, L., Eguaras, M. 2019. Towards precisión nutrition: a novel concept linking phytochemiclas, immune response and honey bee health. Insects, 10(11):401. https://doi.org/10.3390/insects10110401
Noordyke, E. R., van Santen, E., Ellis, J. D. 2021. Evaluating the strength of western honey bee (Apis mellifera L.) colonies fed pollen substitutes over winter. Journal of Applied Entomology, 146:291-300. DOI: 10.1111/jen.12957
Raymann, K., Moran, N. A. 2018. The role of the gut microbiome in health and disease of adult honey bee workers. Current Opinion in Insect Science, 26:97-104.
Ricigliano, V., Simone-Finstrom, S. 2020. Nutritional and prebiotic efficacy of the microalga Arthrospira platensis (spirulina) in honey bees. Apidologie, 51:898-910.
Ricigliano, V. A., Williams, S. T., Oliver, R. 2022. Effects of different artificial diets on commercial honey bee colony performance, health biomarkers, and gut microbiota. BMC Veterinary Research, 18:52. https://doi.org/10.1186/s12917-022-03151-5
Rejoignez la communauté Véto-pharma et recevez notre newsletter trimestrielle ainsi que nos actualités apicoles ponctuelles. Vous pourrez vous en désabonner à tout moment si nos contenus ne vous conviennent pas, et vos données ne seront jamais cédées à un tiers !
© 2019-2025, Véto-pharma. Tous droits réservés