 por Véto-pharma
por Véto-pharma Los apicultores informan cada vez con más frecuencia de picos significativos de infestación por Varroa destructor tras trasladar sus abejas a determinados cultivos [1]. Este fenómeno suscita preocupación por los efectos interactivos de los agroquímicos y las presiones parasitarias sobre la salud de las abejas melíferas. Recientemente, Bartlett y col. 2024 investigan cómo la exposición a los neonicotinoides exacerba las infestaciones por el ácaro Varroa [2]. Este estudio explora la hipótesis de que la exposición a productos agroquímicos, en concreto a los neonicotinoides, contribuye a aumentar la vulnerabilidad de las colonias de abejas melíferas a los ácaros de la varroa y a otros factores de estrés.
Los neonicotinoides, una clase de insecticidas sistémicos, se han utilizado ampliamente en la agricultura debido a su eficacia contra diversas plagas. Sin embargo, su impacto en organismos no diana, sobre todo en polinizadores como las abejas melíferas, ha sido objeto de intensa investigación y regulación [3-4]. Se sabe que los neonicotinoides, como la clotianidina y el tiametoxam, alteran el sistema nervioso central de los insectos, provocándoles parálisis y la muerte en dosis elevadas [5-6]. En dosis subletales, estas sustancias químicas pueden alterar el comportamiento de búsqueda de alimento, el aprendizaje y la memoria de las abejas, afectando en última instancia a la salud y la productividad de las colonias [7]. En Europa, donde los neonicotinoides están prohibidos, ha aumentado el uso de pesticidas alternativos. ¿Cuál es el impacto potencial de estos pesticidas sobre la dinámica del ácaro Varroa y la salud de las abejas melíferas?
Bartlett y col. 2024 [2] demuestran que la exposición a concentraciones de neonicotinoides relevantes para el campo aumenta la gravedad del parasitismo por Varroa destructor en las colonias de abejas melíferas: «También encontramos pruebas de un efecto perjudicial de la exposición a neonicotinoides en las colonias, donde tanto las tasas de caída de ácaros […] como los recuentos de ácaros por lavado […] fueron mayores en las colonias expuestas a neonicotinoides; las colonias expuestas a neonicotinoides tuvieron de media 5,3 […] más caída de ácaros en 24 h y 1,11 […] más ácaros foréticos por cada 100 abejas […].»
Esta interacción puede atribuirse a varios mecanismos:
1. Inmunosupresión
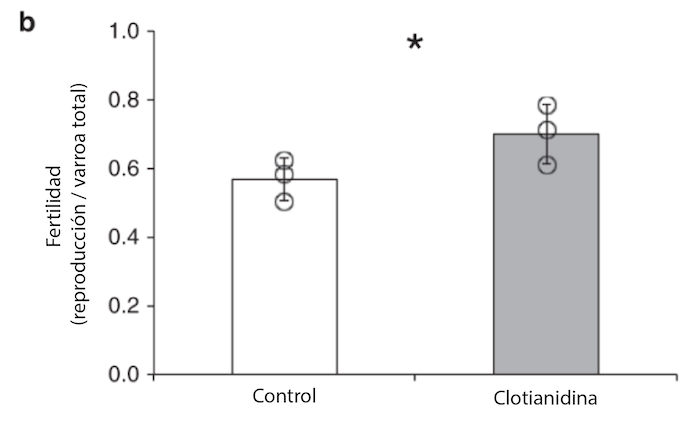
La exposición a los neonicotinoides puede debilitar el sistema inmunitario de las abejas melíferas, haciéndolas más susceptibles a los ácaros Varroa y a las infecciones víricas asociadas [8]. Además, un estudio reciente publicado en Nature destaca un cambio en la fertilidad de los ácaros (ácaros reproductores del total de ácaros), mostrando que los ácaros expuestos a clotianidina exhibieron un aumento medio del 23% en ácaros reproductores [9]. «La fertilidad de los ácaros (es decir, la proporción de hembras reproductoras del total de ácaros hembra utilizados en el experimento) en las pupas de abeja tratadas con 0,01 ppm de clotianidina en la fase larvaria fue significativamente mayor que en las abejas control […] en un 23%, por término medio […]. El aumento observado de la fertilidad de los ácaros que parasitan las larvas de abejas tratadas con clotianidina se debe posiblemente al hecho de que su actividad alimentaria se ve facilitada por la inmunodepresión inducida en el hospedador.»
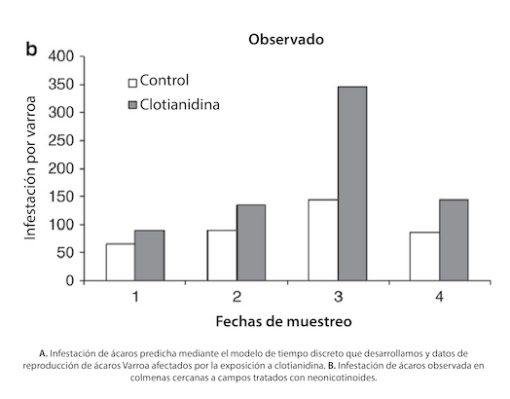
Del mismo modo, la infestación por ácaros fue mayor en las colonias expuestas a clotianidina: «Descubrimos que la infestación de ácaros en colmenas contaminadas con clotianidina podía alcanzar un nivel entre 1,4 y 2,0 veces superior al observado en colmenas no contaminadas, según la estación del año. Este resultado coincide bastante bien con las observaciones realizadas en condiciones de campo, donde se observó una infestación de ácaros entre 1,4 y 2,4 veces superior en colmenas situadas cerca de campos de maíz sembrados con semillas recubiertas de neonicotinoides.»
2. Cambios de comportamiento
Las dosis subletales de neonicotinoides pueden alterar el comportamiento de las abejas, reduciendo su eficacia en tareas como el acicalamiento (grooming), que es crucial para el control del ácaro Varroa [10]. Esta alteración del comportamiento puede conducir a un aumento de la carga de ácaros en la colonia.
3. Toxicidad sinérgica
Los organofosforados y los piretroides, por ejemplo, se han relacionado con el aumento de la carga viral en las abejas, donde el impacto global sobre la salud de las abejas es mayor que la suma de los efectos individuales. Esto puede conducir a tasas de mortalidad más elevadas y a una menor resistencia de las colonias [11].
La investigación in vitro y los estudios de campo han aportado datos sobre el impacto de estos plaguicidas utilizados en la agricultura en las colonias de abejas melíferas y en la dinámica del ácaro Varroa:
1. Piretroides
Estos insecticidas se utilizan ampliamente por su actividad de amplio espectro. Los piretroides, como el tau-fluvalinato, se emplean en apicultura para controlar los ácaros varroa. Los estudios han demostrado que los ácaros de la varroa pueden desarrollar resistencia a los piretroides, lo que hace que estos tratamientos pierdan eficacia con el tiempo. Los ácaros resistentes pueden proliferar, dando lugar a tasas de infestación más elevadas [12-14].
2. Organofosforados
Estas sustancias químicas, como el clorpirifos, afectan al sistema nervioso de los insectos al inhibir la acetilcolinesterasa. Las investigaciones indican que los organofosforados pueden causar toxicidad aguda y crónica en las abejas, alterando sus funciones cognitivas y sus respuestas inmunitarias. Esto puede afectar indirectamente a la gestión del ácaro Varroa al debilitar la salud general de la colonia [15].
3. Fungicidas
Aunque no están dirigidos principalmente contra los insectos, los fungicidas como el clorotalonil y el propiconazol pueden interactuar con otros plaguicidas, potenciando su toxicidad para las abejas y pudiendo afectar indirectamente al comportamiento del ácaro Varroa. Los experimentos han demostrado que los fungicidas pueden potenciar la toxicidad de los insecticidas, provocando un aumento de la mortalidad y efectos subletales en las abejas. Esto puede reducir la capacidad de las abejas para hacer frente a los ácaros de la Varroa y a otros factores de estrés [16].
4. Herbicidas
Se ha demostrado que el glifosato, un herbicida ampliamente utilizado, altera el microbiota intestinal de las abejas melíferas, lo que puede repercutir en su salud general y en su susceptibilidad a plagas y enfermedades [17].
Las observaciones sobre el terreno de los apicultores han mostrado una correlación entre el traslado de las abejas a determinados cultivos y el consiguiente aumento de las infestaciones de Varroa. Esto se ha observado especialmente en cultivos tratados con pesticidas neonicotinoides [2]. En este estudio, las colonias de abejas melíferas expuestas a neonicotinoides mostraron tasas más elevadas de parasitismo del ácaro Varroa en comparación con los grupos de control.
Aunque la diversidad genética dentro de las colonias de abejas melíferas puede mejorar la supervivencia general y la resistencia a los factores estresantes [18], el estudio de Bartlett y col. 2024 [2] indica que no mitiga los efectos negativos de la exposición a los neonicotinoides sobre las tasas de infestación del ácaro Varroa. Se sabe que la diversidad genética mejora la especialización de las tareas y la resistencia a las enfermedades dentro de las colonias, pero el estrés abrumador de los pesticidas parece eclipsar estos beneficios.
La interacción entre la exposición a neonicotinoides y las infestaciones por el ácaro Varroa subraya la complejidad de los factores de estrés que afectan a la salud de las abejas melíferas. Las pruebas sugieren que la exposición a agroquímicos puede exacerbar significativamente las presiones parasitarias, provocando mayores tasas de infestación y comprometiendo la salud de las colonias.
Las conclusiones del estudio referenciado ponen de relieve la urgente necesidad de enfoques integrados de la salud de los polinizadores que tengan en cuenta los retos polifacéticos que plantean las prácticas agrícolas modernas.
REFERENCIAS
 por Véto-pharma
por Véto-pharma  por Véto-pharma
por Véto-pharma El contenido de esta página ha sido redactado para el público Español. Las instrucciones de uso de los medicamentos mencionados cumplen la normativa española. Tabla de contenidos La apicultura implica
 por Véto-pharma
por Véto-pharma Únete a la comunidad Véto-pharma y recibe nuestro boletín trimestral, así como nuestras noticias ocasionales sobre apicultura. Puedes darte de baja en cualquier momento si nuestro contenido no te resulta interesante, ¡y tus datos nunca se transferirán a un tercero!
© 2019-2025, Véto-pharma. Reservados todos los derechos