 par Véto-pharma
par Véto-pharma De plus en plus d’apiculteurs rapportent des pics d’infestations par Varroa destructor après avoir déplacé leurs abeilles vers certaines cultures. Ce phénomène inquiète, car il met en lumière les interactions entre les pesticides et les parasites qui affectent la santé des abeilles. Une étude récente de Bartlett et al. (2024) a examiné comment l’exposition aux néonicotinoïdes aggrave les infestations de varroa, renforçant l’idée que ces produits chimiques augmentent la vulnérabilité des colonies face aux acariens et à d’autres facteurs de stress.
Les néonicotinoïdes, une classe d’insecticides systémiques, ont été largement utilisés en agriculture pour leur efficacité contre de nombreux ravageurs. Cependant, leur impact sur les pollinisateurs, notamment les abeilles, a suscité de nombreuses recherches et mené à des régulations strictes [3-4]. Des substances comme le clothianidine et le thiaméthoxame sont connues pour affecter le système nerveux des insectes, provoquant paralysie et mort à fortes doses [5-6]. À des doses sublétales, elles peuvent perturber le comportement des abeilles, comme le butinage, l’apprentissage et la mémoire, compromettant ainsi la santé et la productivité des colonies [7]. En Europe, où les néonicotinoïdes sont interdits, l’utilisation de pesticides alternatifs a augmenté. Quel impact ces nouveaux produits ont-ils sur le varroa et la santé globale des abeilles?
Bartlett et al. 2024 [2] montrent que l’exposition à des concentrations de néonicotinoïdes pertinentes sur le terrain augmente la gravité du parasitisme par Varroa destructor dans les colonies d’abeilles : « Nous trouvons également des preuves d’un effet néfaste de l’exposition aux néonicotinoïdes sur les colonies, où à la fois les taux de chute des varroas […] et les comptages par lavage […] étaient plus élevés dans les colonies exposées aux néonicotinoïdes ; les colonies exposées aux néonicotinoïdes avaient en moyenne 5,3 […] varroas de plus en chute en 24 heures et 1,11 […] varroas phorétiques de plus par 100 abeilles […]. »
Cette interaction pourrait résulter de plusieurs mécanismes :
1. Immunosuppression: L’exposition aux néonicotinoïdes peut affaiblir le système immunitaire des abeilles, les rendant plus vulnérables aux varroas et aux infections virales associées [8]. Une étude récente publiée dans Nature a également révélé une augmentation significative de la fertilité des varroas exposés au clothianidine, avec une hausse moyenne de 23 % des acariens reproducteurs [9] : « La fertilité des varroas (proportion de femelles reproductrices sur le total des femelles Varroa utilisées dans l’expérience) sur les pupes d’abeilles traitées avec 0,01 ppm de clothianidine à l’état larvaire était significativement plus élevée que chez les abeilles témoins […] de 23 %, en moyenne […]. Cette augmentation est probablement due à l’immunosuppression de l’hôte, facilitant l’activité alimentaire des acariens.. »
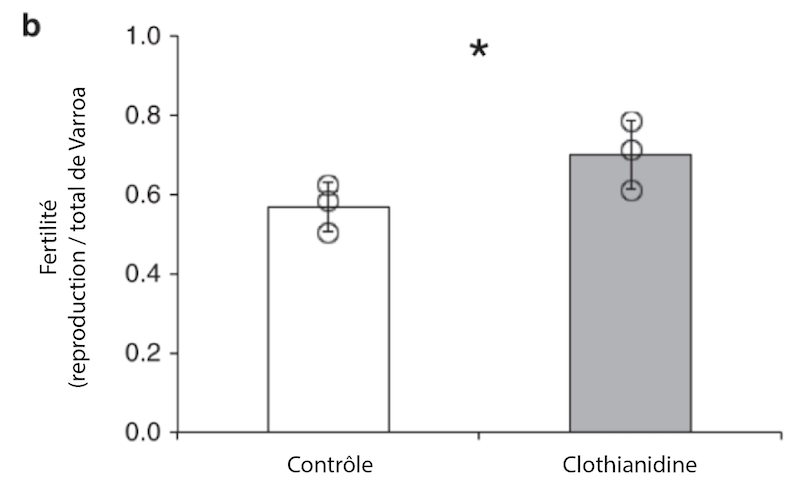
De plus, l’infestation par les varroas était significativement plus élevée dans les colonies exposées au clothianidine : « Nous avons observé que l’infestation par les acariens dans les ruches contaminées par le clothianidine pouvait être 1,4 à 2,0 fois plus élevée que dans les ruches non contaminées, selon la saison. Ce résultat correspond aux observations faites sur le terrain, où une infestation accrue, de 1,4 à 2,4 fois, a été constatée dans les ruches situées près de champs de maïs traités avec des semences enrobées de néonicotinoïdes. »
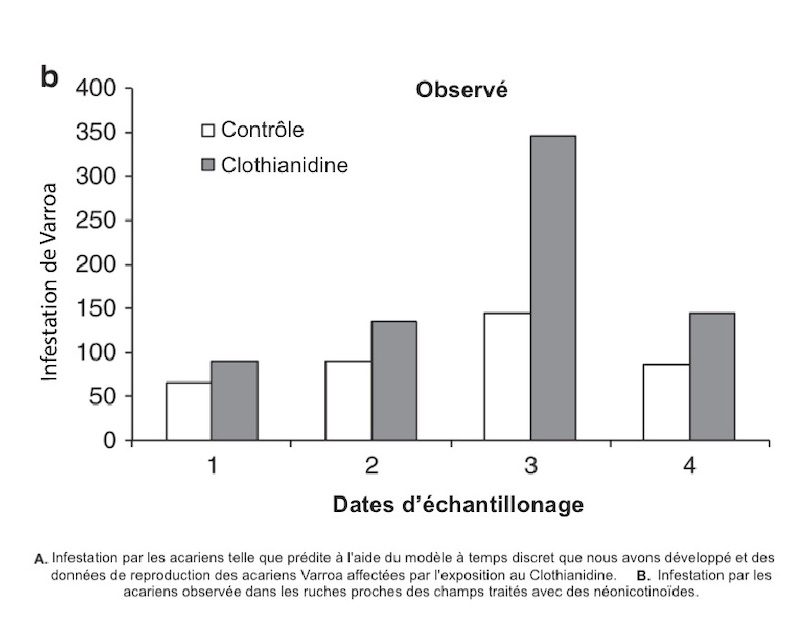
2. Changements de comportement : L’exposition à des doses sublétales de néonicotinoïdes peut perturber le comportement des abeilles, réduisant leur capacité à effectuer des tâches essentielles, comme le toilettage, qui joue un rôle crucial dans la gestion des varroas [10]. Ce dysfonctionnement comportemental peut ainsi conduire à une augmentation de la charge parasitaire au sein de la colonie.
3. Toxicité synergique : Les organophosphates et pyréthrinoïdes ont été associés à une augmentation des charges virales chez les abeilles, où l’impact global sur leur santé dépasse la somme des effets individuels. Cette synergie toxique peut entraîner une mortalité plus élevée et une résilience réduite des colonies [11].
Des recherches en laboratoire et des études de terrain ont apporté des preuves sur l’impact des pesticides agricoles sur les colonies d’abeilles et la dynamique des varroas :
Les observations de terrain des apiculteurs ont révélé une corrélation entre le déplacement des abeilles vers certaines cultures et une augmentation des infestations par les varroas, en particulier dans les cultures traitées aux néonicotinoïdes [2]. Dans cette étude, les colonies exposées aux néonicotinoïdes ont montré des taux de parasitisme par les varroas nettement plus élevés que les colonies témoins.
Bien que la diversité génétique au sein des colonies d’abeilles améliore leur survie et leur résilience face aux stress [18], l’étude de Bartlett et al. (2024) [2] montre qu’elle ne compense pas les effets néfastes de l’exposition aux néonicotinoïdes sur les taux d’infestation par les varroas. La diversité génétique, bien qu’elle favorise la spécialisation des tâches et la résistance aux maladies, semble être surpassée par le stress important induit par les pesticides, réduisant ses avantages.
Les résultats de cette étude montrent l’importance de repenser les pratiques apicoles, notamment dans les régions où les cultures sont traitées avec des néonicotinoïdes. Ces produits chimiques peuvent aggraver les infestations de varroa, compromettant ainsi la santé des colonies d’abeilles. Il est donc essentiel que les apiculteurs soient conscients de ces risques et explorent des stratégies alternatives pour limiter l’impact des pesticides sur leurs ruches. Comprendre les interactions complexes entre les néonicotinoïdes, le varroa et la santé des abeilles est crucial pour développer des approches intégrées adaptées aux défis posés par l’agriculture moderne.
Références:
 par Véto-pharma
par Véto-pharma Le contenu de cette page a été rédigé à destination du public Français. Les instructions d’emploi des médicaments mentionnés sont conformes à la réglementation Française. Table des matières Dans le
 par Véto-pharma
par Véto-pharma  par Véto-pharma
par Véto-pharma Rejoignez la communauté Véto-pharma et recevez notre newsletter trimestrielle ainsi que nos actualités apicoles ponctuelles. Vous pourrez vous en désabonner à tout moment si nos contenus ne vous conviennent pas, et vos données ne seront jamais cédées à un tiers !
© 2019-2025, Véto-pharma. Tous droits réservés